
國家臨床試驗機構(gòu)資質(zhì)
一、項目介紹
輔助并協(xié)助院方獲得兩個資質(zhì):
1.國家藥物臨床實驗機構(gòu)
2.國家醫(yī)療器械臨床實驗機構(gòu)
主管單位:
? 國家食品藥品監(jiān)督管理局主管全國資格認(rèn)定管理工作;
? 國家衛(wèi)生健康委員會在其職責(zé)范圍內(nèi)負(fù)責(zé)資格認(rèn)定管理的有關(guān)工作;
? 省、自治區(qū)、直轄市食品藥品監(jiān)督管理局(藥品監(jiān)督管理局)和衛(wèi)建委負(fù)責(zé)本行政區(qū)域內(nèi)資格認(rèn)定的初審和形式審查及日常監(jiān)督管理工作。
二、行業(yè)背景
市場背景:
政策背景:我國目前藥品生產(chǎn)廠家總數(shù)7916家,醫(yī)療器械生產(chǎn)廠家共有28956家。隨著國家對居民健康越來越重視,在健康密切相關(guān)的醫(yī)療領(lǐng)域也得到更多人的關(guān)注,新型醫(yī)療器械或藥品的上市需要有資質(zhì)的臨床試驗機構(gòu)來進行安全性和有效性的驗證。
我國一直對臨床試驗機構(gòu)實行資格認(rèn)定,2021年全國醫(yī)療機構(gòu)總數(shù)1043621家,而取得臨床試驗機構(gòu)資質(zhì)的醫(yī)療機構(gòu)僅有1000余家,占比不足1%。隨著我國在醫(yī)藥創(chuàng)新領(lǐng)域取得明顯突破,臨床研究資源的短缺問題日益凸顯。
為解決臨床研究資源短缺,李克強總理2021年簽署中華人民共和國國務(wù)院739號令,其中第二十六條:
國家支持醫(yī)療機構(gòu)開展臨床試驗,將臨床試驗條件和能力評價納入醫(yī)療機構(gòu)等級評審,鼓勵醫(yī)療機構(gòu)開展創(chuàng)新醫(yī)療器械臨床試驗。
三、醫(yī)院申報條件
醫(yī)院范圍:全部二級甲等以上醫(yī)院
四、項目意義和價值
1.有利于提升醫(yī)院的品牌與知名度
? 目前全國擁有臨床試驗機構(gòu)備案資質(zhì)的醫(yī)院僅有1000余家,且主要集中在知名三甲醫(yī)院;? 如果醫(yī)院能躋身于此行列,將在一定程度上提升醫(yī)院的品牌與知名度。
2.有利于醫(yī)院科研水平的提升和人才的引進
? 有利于醫(yī)院承接科研課題和科研項目;? 有利于醫(yī)院的等級評定和復(fù)審(科研能力);? 有利于醫(yī)院關(guān)于循證醫(yī)學(xué)研究的開展;? 有利于醫(yī)護人員發(fā)表高質(zhì)量論文;? 有利于促進醫(yī)護人員的合理用藥。
3.有利于規(guī)范和提高醫(yī)院的醫(yī)療服務(wù)能力
? 有利于增強醫(yī)務(wù)人員的患者服務(wù)意識;? 有利于醫(yī)院倫理工作的規(guī)范;? 有利于提高醫(yī)院的醫(yī)療服務(wù)能力。
4.有利于醫(yī)院的經(jīng)濟創(chuàng)收
? 醫(yī)院在擁有臨床試驗機構(gòu)備案資質(zhì)后,將可以承接藥物和醫(yī)療器械的臨床試驗項目;? 醫(yī)療器械臨床試驗項目,根據(jù)II類和III類的不同,申辦者支付給醫(yī)院的試驗費用在幾十萬至上百萬;? 藥物臨床試驗項目,則更是動輒數(shù)百萬的臨床試驗費用支付給醫(yī)院,極大的有利于醫(yī)院的經(jīng)濟創(chuàng)收。
五、機構(gòu)備案審批難點
1.無相關(guān)專業(yè)人員
2.通過率低
3.效率低
4.耗時長
5.耗費大量人力
6.培訓(xùn)難度大
六、項目服務(wù)流程
七、項目服務(wù)內(nèi)容
1.整體方案設(shè)計
醫(yī)院整體性調(diào)研與評估;醫(yī)院當(dāng)前管理體系調(diào)研與評估;參與臨床試驗科室的調(diào)研與評估;參與臨床試驗全體研究人員的評估;項目可行性方案的編制;全套項目解決方案的設(shè)計與輸出。
2.管理體系建設(shè)
項目啟動會;臨床試驗全套管理制度的制定;臨床試驗標(biāo)準(zhǔn)操作規(guī)程的制定;臨床試驗參與人員各崗位職責(zé)的編制;臨床試驗全程計劃書的制定;倫理相關(guān)制度規(guī)范的制定;不良事件的應(yīng)急處理預(yù)案的制定;申辦者與研究者相關(guān)合同的撰寫與管理。
3.系統(tǒng)培訓(xùn)
臨床試驗相關(guān)法規(guī)培訓(xùn);質(zhì)量管理體系培訓(xùn);標(biāo)準(zhǔn)化操作規(guī)程培訓(xùn);倫理委員會體系文件培訓(xùn);參與臨床試驗實施的研究人員GCP培訓(xùn);藥物及醫(yī)療器械臨床試驗相關(guān)質(zhì)量管理規(guī)范培訓(xùn);臨床試驗的組織管理和質(zhì)量控制能力輔導(dǎo);不良事件的應(yīng)急機制和處置能力培訓(xùn);臨床試驗項目規(guī)范化管理的培訓(xùn);受試者的招募原則和知情同意書的管理培訓(xùn);現(xiàn)場核查預(yù)演的指導(dǎo)培訓(xùn);國家局現(xiàn)場核查驗收的全程指導(dǎo)。
4.臨床試驗機構(gòu)建立
臨床試驗機構(gòu)辦公場所基礎(chǔ)設(shè)施的建立指導(dǎo);臨床試驗機構(gòu)專業(yè)科室基礎(chǔ)設(shè)施的建立指導(dǎo);臨床試驗機構(gòu)中心藥房的建立指導(dǎo);臨床試驗機構(gòu)檔案室的建立指導(dǎo);參與臨床試驗全體研究人員的專業(yè)化實戰(zhàn)指導(dǎo)。
5.臨床試驗倫理委員會建立
臨床試驗機構(gòu)辦公場所基礎(chǔ)設(shè)施的建立指導(dǎo);臨床試驗機構(gòu)專業(yè)科室基礎(chǔ)設(shè)施的建立指導(dǎo);臨床試驗機構(gòu)中心藥房的建立指導(dǎo);臨床試驗機構(gòu)檔案室的建立指導(dǎo);參與臨床試驗全體研究人員的專業(yè)化實戰(zhàn)指導(dǎo)。臨床試驗機構(gòu)倫理委員會的建立指導(dǎo);搭建符合法規(guī)的倫理委員會人員配置;參與倫理委員會相關(guān)人員的專業(yè)化實戰(zhàn)指導(dǎo)并取得倫理GCP證書;制定倫理委員會相關(guān)工作指南、工作制度、操作規(guī)程;完成衛(wèi)健委倫理委員會的系統(tǒng)備案。
6.國家臨床試驗機構(gòu)資質(zhì)備案
申請并獲得臨床試驗國家局備案賬號;藥物及醫(yī)療器械臨床試驗機構(gòu)第三方評估;模擬臨床試驗;邀請行業(yè)專家模擬檢查;現(xiàn)場檢查后協(xié)助整改;通過國家臨床試驗機構(gòu)資質(zhì)備案和審核。
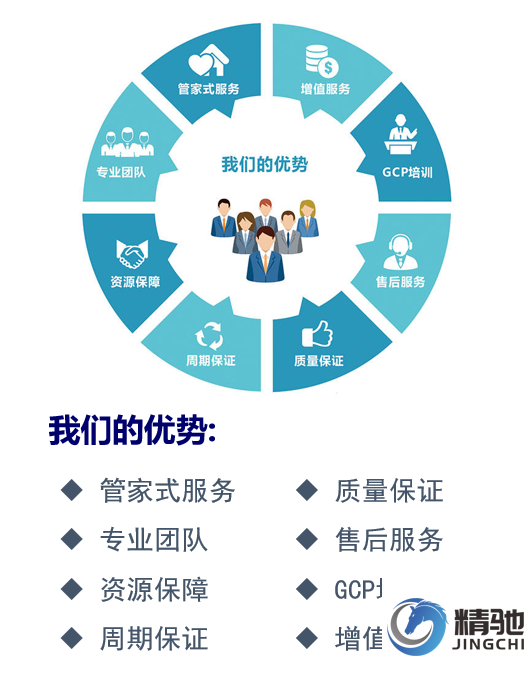
精馳公司關(guān)于機構(gòu)備案業(yè)務(wù)辦理的承諾:
· 周期保障:承諾80個工作日申辦成功
從國家藥監(jiān)局收到申請材料之日起,到資質(zhì)申辦成功,周期不超過80個工作日。
· 質(zhì)量保障:申辦不成功,承諾全額退款
由于精馳公司原因?qū)е沦Y質(zhì)申辦不成功,承諾全額退款(在合同條款中明確約定)。